- 公司地址
-
上海市浦东新区金桥路27号
邮编:
- 联系电话
- 4008****82登录查看商家电话
- 传真号码
- 电子邮箱
- peprotech.infochina@****mofisher.com登录查看商家邮箱
- 公司网址
- www.peprotech.com
冠状病毒防御战,PeproTech与您聊一聊 — “双子座”巨噬细胞!
发布时间:2021-11-11 15:40 | 点击次数:
 |
| 您了解冠状病毒吗? |
| 冠状病毒(CoV)是自然界广泛存在的一类病毒,因该病毒的形态在电镜下观察类似王冠而得名。其基因总长约28~32 kb,基因组大致可分成6到7个区域,每个区域均包含至少1条开放阅读框(opten-reading frame,ORF)。CoV颗粒的直径约60~200 nm,平均直径为100 nm,呈球形或椭圆形,是目前发现最大的RNA类病毒。 |
| ┇ CoV主要有4种结构蛋白~ ┇ |
 |
| 少数冠状病毒还具有血凝素酯酶(Hemagglutinin esterase, HE)糖蛋白。 |
 |
| 图1:冠状病毒结构模式图 |
| ▲▼ 新冠病毒的特性 ▼▲ |
| 目前为止发现冠状病毒仅感染脊椎动物,可引起人和动物呼吸道、消化道、泌尿生殖系统和神经系统疾病。2019新型冠状病毒(COVID-19)是新发现的可以感染人和动物的冠状病毒,是目前已知的第7种可以感染人的冠状病毒,其余6种分别是HCoV-229E、HCoV-OC43、HCoV-NL63、HCoV-HKU1、SARS-CoV(引发重症急性呼吸综合征)和MERS-CoV(引发中东呼吸综合征)。 COVID-19传播途径主要是呼吸道飞沫传播、接触传播和粪-口传播,气溶胶等其它传播途径尚待进一步明确。感染了COVID-19后患者常伴有呼吸道症状、发热、咳嗽、气促和呼吸困难等,在较严重病例中,感染可导致肺炎、严重急性呼吸综合征、肾衰竭,甚至死亡。目前对于COVID-19所致疾病没有有效治疗方法,一般根据患者临床症状进行对症治疗。此外,患者免疫功能的状态直接影响疾病的预后与转归。 少数冠状病毒还具有血凝素酯酶(Hemagglutinin esterase, HE)糖蛋白。 |
| ▲▼ 巨噬细胞在病毒感染后的作用 ▼▲ |
| 巨噬细胞是机体最重要的免疫细胞之一,在流感病毒感染后,巨噬细胞可迅速到达肺部感染处,对局部微环境反应的不同,巨噬细胞会发生不同类型的极化。根据极化后巨噬细胞的表面标志物及其功能,可将极化后的巨噬细胞类型分为经典活化的巨噬细胞(Classically activated macrophage, M1)和替代性活化的巨噬细胞(Alternatively activated macrophage, M2)两大类。 M1型巨噬细胞能吞噬并清除外来病原体,激活T细胞的免疫反应,分泌促炎因子,参与细胞因子风暴的形成,加速细胞外基质降解和细胞凋亡,调节并促进Th1型免疫应答。 M2型巨噬细胞能促进组织修复和伤口愈合,调节Th2 型免疫应答,有助于组织重塑。而性激素可以调控巨噬细胞的极化,已有文献报道雌激素在病毒感染性疾病中具有保护作用,究其原因是雌激素可以诱导巨噬细胞向M2型巨噬细胞方向分化,减轻机体的炎症反应,有利于疾病的转归[4, 5]。结合COVID-19感染后女性发病程度较轻,并且死亡率较男性低的特点,可以推测在雌激素的影响下,M1/M2 的不平衡极化在COVID-19感染中起着重要作用,调控巨噬细胞极化的方向有望能改善疾病的发生发展,因此深入了解巨噬细胞的生物学功能及极化机制对病毒感染相关疾病的预防和治疗具有一定的指导意义。 接下来将就巨噬细胞起源、极化以及鉴定做进一步总结,希望能有助于大家研究巨噬细胞。 |
| 巨噬细胞 |
| ▲▼ 巨噬细胞的起源 ▼▲ |
| 巨噬细胞(Macrophage)是单核吞噬细胞系统晚期分化细胞,是机体的主要免疫细胞,在先天性免疫和获得性免疫反应中都起着重要的作用,它由骨髓造血祖细胞发育分化释放进入外周血,随后进一步分化为组织定居的巨噬细胞,如肺脏中的尘细胞、肝脏中的库普弗细胞(Kupffer cell)、皮肤中的朗格汉斯细胞(langerhans cell)、脑组织中的小胶质细胞和骨组织中的破骨细胞等[6]。单核细胞在分化为巨噬细胞的过程中,形态和功能发生较大改变,主要表现为体积增大、细胞器数量增加、吞噬功能增强并能分泌大量可溶性细胞因子等。机体所受到的免疫刺激、分泌的促炎因子以及代谢因素均能够促进单核细胞向外周组织中迁移并分化为巨噬细胞,以增强机体防御,组织重塑和修复[7]。 巨噬细胞具有异质性和多样性,在体液免疫和细胞免疫中均发挥着不可替代的作用,受不同因素刺激时巨噬细胞会发生不同类型的极化,根据极化后巨噬细胞的表面标志物及其功能,可将极化后的巨噬细胞类型分为经典活化的巨噬细胞(Classically activated macrophage, M1)和替代性活化的巨噬细胞(Alternatively activated macrophage, M2)两大类。M1型巨噬细胞能吞噬并清除外来病原体,分泌促炎因子,激活T细胞的免疫反应,在炎症初期发挥重要作用。M2型巨噬细胞能促进组织修复和伤口愈合,在炎症后期有利于疾病的恢复。Mantovani等提出进一步对M2细胞进行亚型分类:由IL-4或IL-13诱导产生的M2a型巨噬细胞、由Toll样受体(toll like receptors,TLRs)的配体诱导产生M2b型巨噬细胞和由IL-10和糖皮质激素诱导产生的M2c型巨噬细胞[8]。在炎症反应过程中巨噬细胞的极化能够相互转换,发挥不同功能,在炎症早期M1型巨噬细胞通过释放促炎细胞因子,招募和激活适应性免疫细胞,从而诱导Th1 和Th17 反应,在促进炎症反应过程中可能会对机体正常组织造成损伤,而当机体处于炎症恢复阶段时,这些细胞可以转化为M2 型巨噬细胞,抑制炎症反应,从而诱导Th2 反应,参与组织愈合和修复[9]。 |
| ▲▼ 体外巨噬细胞极化方案 ▼▲ |
| 人的巨噬细胞包括经典活化型巨噬细胞(Classical activated macrophages, M1)、替代活化型巨噬细胞(Alternatively activated macrophages, M2)以及未刺激活化的巨噬细胞(M0)。人巨噬细胞的体外分化由单核细胞而来,M0 型巨噬细胞用含自体血清(10%)的完全培养基培养单核细胞6 天,隔天半量换液即可;M1 型巨噬细胞分化用 20ng/ml 的 GM-CSF 分化单核细胞 6 天,或者用 20ng/ml的 M-CSF 分化 6 天,并加 20ng/ml 的 IFN-γ 和LPS极化 1 天;M2 型巨噬细胞用 20ng/ml的 M-CSF 分化 6 天,并加20ng/ml的 IL-4/IL-10极化 1 天。在显微镜下观察完成分化的细胞形态发现 M1细胞贴壁最牢,呈梭形;M2 细胞贴壁能力较M1弱,呈圆形或椭圆形;M0 细胞贴壁中等,呈圆形(图2)。 |
 |
| 图2:人巨噬细胞极化步骤 |
| 而体外小鼠的巨噬细胞的研究由骨髓细胞分化而来,骨髓细胞加入 20ng/ml M-CSF,隔天半量换液,诱导分化 6 天后即为 BMDM0,加 20ng/ml IFN-γ和LPS极化一天分化为BMDM1;加20ng/ml的IL-4/IL-10极化一天,即分化为 BMDM2(图3)。 |
 |
| 图3:小鼠巨噬细胞极化步骤 |
| ▲▼ 巨噬细胞的鉴定 ▼▲ |
| 对分化后的人单核细胞来源的巨噬细胞进行表型鉴定发现M1型巨噬细胞CD14 高表达,清道夫受体(Scavenger receptors, SR,CD163)低表达,甘露糖受体(Mannose receptors, MR, CD206)不表达;在 M2 细胞中,CD14 高表达,CD163 和 CD206均高表达; 在 M0 细胞中,CD14 高表达,CD163 低表达,CD206 中表达。同时对三种巨噬细胞进行分泌细胞因子的鉴定,M0、M1 细胞经LPS活化后,以释放大量促炎性细胞因子 TNF-α 为主,几乎不释放 IL-10;而M2 细胞经LPS活化后,则以释放大量抑炎性细胞因子 IL-10 为主,只释放少量的 TNF-α[10]。 对小鼠骨髓细胞来源的不同亚型巨噬细胞分泌的细胞因子分析发现:M1型巨噬细胞IL-12 水平显著上升, 其IL-10 的分泌略有增加,同时高表达iNOS;而M2型巨噬细胞其IL-10分泌水平明显增加, 而IL-12 水平很低,Arginase-Ⅰ的表达和活性显著增加。其表面标志性分子表达分析:M2 与M1 型巨噬细胞相比,CD163、CD206 和Dectin-1 表达明显上调[4]。 |
| ▲▼ 巨噬细胞功能 ▼▲ |
| M1型巨噬细胞由IFN-γ及LPS等极化产生,释放TNF-α、IL-1β、IL-6、IL-12、IL-23等促炎性细胞因子,抗原提呈能力和吞菌能力增强,作为抗原提呈细胞(antigen presenting cells, APCs),能够促进适应性免疫应答的发生。M2型巨噬细胞由IL-4 或IL-13 诱导,CD206 和精氨酸酶表达增高,内吞能力增强,分泌IL-10、TGF-β等抑炎性细胞因子、促进Th2细胞分化,发挥免疫调节及组织修复功能,其抗原提呈能力较弱,在寄生虫免疫反应、变态反应、伤口愈合和组织重构中发挥重要作用[5, 11]。M2 型巨噬细胞的不同亚型分别发挥不同功能(图4)。M2a 由IL-4 或IL-13诱导产生,高表达CD206,内吞活性增强,促进细胞生长和组织修复,介导 Th2 型免疫反应。M2b 由免疫复合物和LPS /IL-1 刺激诱导产生,可以同时产生抗炎和促炎细胞因子IL-10、IL-1β、IL-6,执行免疫调节功能,并能促进Th2活化并增强体液免疫。M2c 型巨噬细胞,又称失活型巨噬细胞,由糖皮质激素、IL-10 或TGF-β 诱导产生,低表达MHCII 分子,在基质沉淀和组织重塑中发挥作用,此外,M2c型巨噬细胞可通过释放大量的IL-10和TGF-β抑制免疫反应,对凋亡细胞表现出强烈的抗炎作用[5, 12]。 |
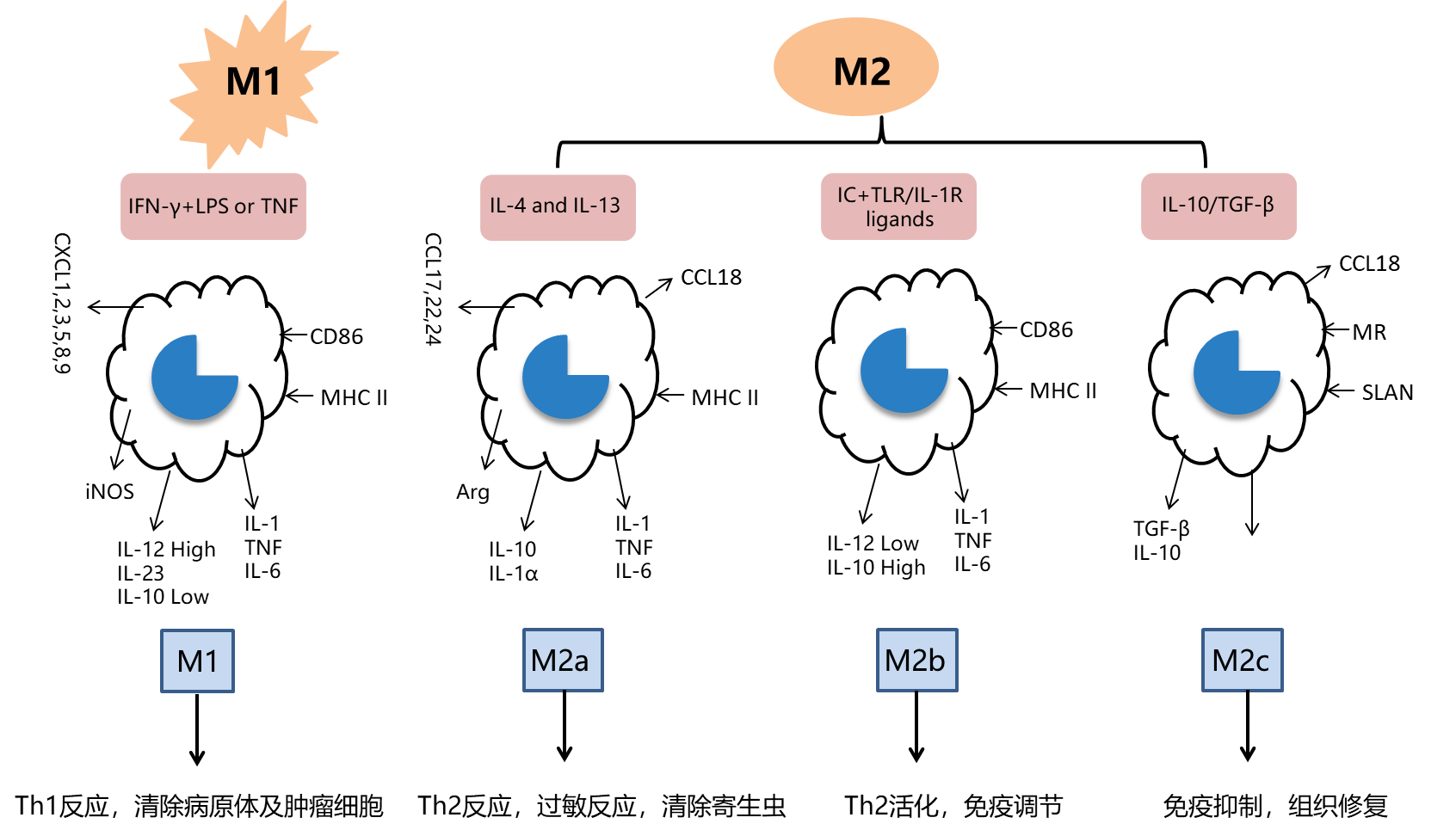 |
| 图4:不同巨噬细胞亚型功能 |
| ▲▼ 病毒感染调控巨噬细胞极化过程 ▼▲ |
| 在病毒感染急性期,巨噬细胞向M1方向极化,M1型巨噬细胞可促进炎症反应,辅助机体清除病原体,但其过度活化可引起细胞因子风暴,加重组织的免疫病理损伤,且M1 型巨噬细胞极化比例与病情严重程度呈正相关; 随着病毒感染相关疾病的进展,巨噬细胞向M2方向极化,M2型巨噬细胞可通过分泌多种抑炎因子发挥免疫调控作用,参与组织修复[13, 14]。巨噬细胞极化不是M1 /M2 两个极端,而是一个连续的巨噬细胞活化谱。Herbein等基于逆转录病毒感染提出了M1 /M2 重塑模型,即在感染早期M1型巨噬细胞极化占优势,M1型巨噬细胞是机体细胞因子风暴和免疫病理损伤产生的重要因素。在感染慢性期M2型巨噬细胞极化占优势,促进组织修复并重建免疫稳态抑制M1型巨噬细胞方向极化,有利于控制炎症反应,改善急性病毒感染患者的疾病预后[15]。 |
| 巨噬细胞是一种异质性与可塑性较强的细胞,在病毒感染诱导炎症反应的进展和消退中巨噬细胞极化发挥重要的双重调控作用,是极具潜力的治疗急性病毒感染所致疾病的细胞。阐明巨噬细胞极化在病毒感染过程中的作用及相关调控机制,可为病毒感染性疾病的发病机制研究及治疗策略提供新的思路。 |
| 巨噬细胞研究用相关产品 |
| ▲▼ 培养用细胞因子 ▼▲ |
 |
| 参考文献 |
| 1.McBride, R., M. van Zyl, and B.C. Fielding, The coronavirus nucleocapsid is a multifunctional protein. Viruses, 2014. 6(8): p. 2991-3018. 2.Wan., S., et al., Characteristics of lymphocyte subsets and cytokines in peripheral blood of 123 hospitalized patients with 2019-nCoV pneumonia (NCP). medRxiv, 2020. 3.Yang., Y., et al., Epidemiological and clinical features of the 2019 novel coronaries outbreak in China. merci, 2020. 4.Li, K., et al., Differential macrophage polarization in male and female BALB/c mice infected with coxsackievirus B3 defines susceptibility to viral myocarditis. Circulation research, 2009. 105(4): p. 353-64. 5.Mantovani, A., et al., The chemokine system in diverse forms of macrophage activation and polarization. Trends in immunology, 2004. 25(12): p. 677-86. 6.Volkman, A. and J.L. Gowans, The Origin of Macrophages from Bone Marrow in the Rat. British journal of experimental pathology, 1965. 46: p. 62-70. 7.Gordon, S. and P.R. Taylor, Monocyte and macrophage heterogeneity. Nature reviews. Immunology, 2005. 5(12): p. 953-64. 8.Mantovani, A., C. Garlanda, and M. Locati, Macrophage diversity and polarization in atherosclerosis: a question of balance. Arteriosclerosis, thrombosis, and vascular biology, 2009. 29(10): p. 1419-23. 9.Qin, H., et al., SOCS3 deficiency promotes M1 macrophage polarization and inflammation. Journal of immunology, 2012. 189(7): p. 3439-48. 10.Gao, C.H., et al., Lactoferrin-Containing Immunocomplexes Drive the Conversion of Human Macrophages from M2- into M1-like Phenotype. Frontiers in immunology, 2018. 9: p. 37. 11.Martinez, F.O., et al., Macrophage activation and polarization. Frontiers in bioscience : a journal and virtual library, 2008. 13: p. 453-61. 12.Murray, P.J., et al., Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity, 2014. 41(1): p. 14-20. 13.Atri, C., F.Z. Guerfali, and D. Laouini, Role of Human Macrophage Polarization in Inflammation during Infectious Diseases. International journal of molecular sciences, 2018. 19(6). 14.Halstead, E.S., et al., GM-CSF overexpression after influenza a virus infection prevents mortality and moderates M1-like airway monocyte/macrophage polarization. Respiratory research, 2018. 19(1): p. 3. 15.Herbein, G. and A. Varin, The macrophage in HIV-1 infection: from activation to deactivation. Retrovirology, 2010. 7: p. 33. |